Le altissime percentuali di successo a medio e lungo termine delle riabilitazioni protesiche effettuate con l’utilizzo di impianti osteointegrati, sia in pazienti totalmente edentuli che in pazienti parzialmente edentuli, hanno rappresentato per i ricercatori ed i clinici la conferma della correttezza dei principi che la comunità scientifica internazionale aveva posto alla base del processo biologico dell’osteointegrazione (Romeo et al., 2004). Tra questi un elemento fondamentale è rappresentato dalla presenza di un adeguata quota ossea che permetta di accogliere l’impianto nella posizione tridimensionalmente ideale per garantire ai pazienti riabilitazioni dentarie morfologicamente, funzionalmente ed esteticamente ottimali.
Prima di qualsiasi ulteriore considerazione clinica, va però precisato che questa “quota ossea” deve essere in un rapporto adeguato con l’arcata antagonista, in maniera da poter permettere non solo una corretta riabilitazione estetica e funzionale, ma consentire anche una fisiologica trasmissione delle forze lungo l’asse maggiore dell’impianto. Infatti la riduzione dei carichi funzionali in direzioni eccentriche, pur non influenzando sensibilmente il processo biologico dell’osteointegrazione ossea già avvenuta (Isidor, 1996), sicuramente contribuisce a diminuire quelle forze/stress potenzialmente pericolose per le componentistiche implantari e/o protesiche.
L’adeguatezza delle dimensioni ossee della cresta edentula comporta che lo spessore osseo in senso vestibolo linguale/palatale deve poter permettere l’inserimento dell’impianto in una posizione ideale per la futura riabilitazione protesica e mantenere intorno allo stesso una quota di osso residua di almeno 1 mm da entrambi i lati. In senso mesio-distale lo spazio edentulo dovrà consentire il ristabilimento di corretti spazi interprossimali capaci di poter permettere una efficiente detersione meccanica.
A tale scopo è ormai da tutti riconosciuto che tale dimensione mesi-distale deve misurare almeno 7-8 mm tra i punti di contatto degli elementi contigui per poter accogliere correttamente un impianto con una piattaforma protesica di circa 5mm come quella “standard” degli impianti Straumann. Infine in senso corono-apicale devono essere presenti almeno 8 mm per poter procedere all’inserimento di impianti di lunghezza “standard”.
Dopo l’estrazione di un elemento dentario, al fine di usufruire di un osso ben mineralizzato capace di permettere una stabilità immediata dell’impianto appena inserito, bisogna attendere almeno 4-6 mesi. (Chen et al., 2004; Cardaropoli et al., 2005)
Questo periodo di attesa rappresenta certamente un disagio per i pazienti, i quali chiedono, sempre con maggiore insistenza, di diminuire i tempi di attesa per una riabilitazione impianto-protesica.
In ogni caso, in relazione o meno ai molteplici fattori che possono influenzare l’entità della guarigione ossea post-estrattiva (ad es. patologie causa dell’estrazione, maggiore o minore trauma chirurgico estrattivo, biotipo osseo, biotipo gengivale, tempo trascorso, ecc.), è stato dimostrato che vi è sempre un rimodellamento osseo più o meno marcato che si evidenzia con un riassorbimento della corticale vestibolare (Cardaropoli et al., 2003) che può rendere più complesso il posizionamento successivo degli impianti.
Secondo Carlsson e Persson dopo 6 mesi dall’estrazione del dente si osserva un riassorbimento osseo che in media è pari al 23% della cresta residua e che si incrementa di un ulteriore 11% nei due anni successivi.
Allo scopo di ridurre i tempi di trattamento ed evitare o diminuire il riassorbimento osseo post-estrattivo, i clinici hanno utilizzato impianti inseriti precocemente negli alveoli post-estrattivi contestualmente all’estrazione del dente (impianti post-estrattivi immediati) o subito dopo la guarigione dei tessuti molli (impianto post-estrattivo ritardato).
In passato, però, l’utilizzo di impianti di morfologia cilindrica e superficie in titanio liscia, l’uso di membrane irriassorbibili (spesso esposte nel cavo orale già nel momento del loro posizionamento), conoscenze biologiche della guarigione ossea meno precise e tecniche chirurgiche più approssimative comportavano, soprattutto nel caso di inserimento di impianti post-estrattivi immediati, un alta percentuali di insuccessi (Gher et al., 1994).
Oggi invece l’utilizzo di impianti a superficie rugosa (più osteofila), con una morfologia tronco-conica per ridurre gli spazi con le pareti ossee alveolari, l’uso di membrane riassorbibili e di tecniche chirurgiche più sofisticate e ,soprattutto, le maggiori conoscenze scientifiche acquisite sui processi biologici della guarigione ossea, hanno significativamente incrementato le percentuali di successo con risultati ben oltre il 92-93% (Chen et al., 2004).
Oggi gli impianti sono definiti post-estrattivi se vengono inseriti all’interno di alveoli naturali. Questi si distinguono in: immediati o di tipo I (caratterizzati dall’inserimento dell’impianto all’interno dell’alveolo naturale immediatamente dopo l’estrazione del dente e come parte dello stesso atto chirurgico), e ritardati o di tipo II (caratterizzati dall’inserimento dell’impianto all’interno dell’alveolo naturale almeno 4-8 settimane dopo l’estrazione, cioè dopo l’avvenuta guarigione dei tessuti molli).
Entrambe queste metodiche permettono di sfruttare al massimo le proprietà riparative dell’osso per la presenza nell’alveolo di una notevole quantità di fattori di crescita che influenzano notevolmente la neovascolarizzazione del sito e la proliferazione di cellule ossee.
I vantaggi nel posizionare immediatamente l’impianto in un alveolo post-estrattivo sono fondamentalmente legati alla riduzione del numero degli atti chirurgici e del tempo di trattamento, mentre gli svantaggi vanno ricercati soprattutto nella morfologia del sito che potrebbe non essere ottimale per il posizionamento e la stabilizzazione dell’impianto, nella presenza di mucosa cheratinizzata che potrebbe risultare insufficiente per un ottimale adattamento del lembo, soprattutto in presenza di un biotipo gengivale sottile.
L’impianto post-estrattivo ritardato presenta, invece, il vantaggio di avere una quantità ed un volume di tessuto mucoso maggiore (che rende più semplice il “management” dei tessuti molli) e di essere posizionato in un alveolo privo di patologie in atto, mentre gli svantaggi sono legati essenzialmente ad un incremento del tempo di trattamento (4-8 settimane) e, soprattutto, ad un iniziale riassorbimento della parete ossea che potrebbe rendere più complessa la morfologia del sito postestrattivo.
A tale riguardo va precisato che studi clinici sui processi di rigenerazione ossea hanno dimostrato che in caso di uno spazio minore di 2 mm tra le pareti ossee dell’alveolo e la superficie dell’impianto post-estrattivo si ha una guarigione ossea ottimale ed il raggiungimento dell’osteointegrazione dell’impianto senza la necessità di mettere in atto alcuna procedura chirurgica aggiuntiva. Invece, in caso di “gap” ossei maggiori di 2 mm o nei casi in cui l’inserimento dell’impianto post-estrattivo si associ alla presenza di un riassorbimento di una o più pareti dell’alveolo, vi è la necessità di mettere in atto procedure aggiuntive di rigenerazione ossea mediante l’utilizzo di membrane ed innesti ossei (Hämmerle et al., 2004).
In entrambi i casi, però, va affermato che tali metodiche sono molto sensibili per la difficoltà di controllare i molteplici parametri che intervengono nel processo di guarigione ossea e dei tessuti mucosi perimplantari.
Ad oggi gli impianti post-estrattivi sono stati utilizzati soprattutto nella sostituzione di denti mono o biradicolati. Ciò significa che sono stati utilizzati soprattutto nelle regioni anteriori del cavo orale sia perché sono richiesti dai pazienti per ridurre i tempi di trattamento in zone ad alta rilevanza estetica, sia perché i clinici utilizzano tali siti con maggiore facilità per il più semplice accesso e per la possibilità di inserire gli impianti in una posizione ottimale dal punto di vista protesico, con una buona stabilità primaria e con un gap osso-impianto di minime dimensioni.
Nelle zone posteriori le minori esigenze estetiche e la presenza, in genere, di un osso di maggiore volume ha evitato l’utilizzo di tecniche post-estrattive nelle zone posteriori. Inoltre, diversamente dalle zone frontali, l’eventuale inserimento di un impianto post-estrattivo nelle regioni molari comporta, nella maggior parte dei casi, la necessità di utilizzare i setti inter-radicolari (spesso molto esigui) per l’ancoraggio e la stabilizzazione dell’impianto. Come conseguenza di ciò vi è la presenza di un gap di notevoli dimensioni tra le pareti ossee e l’impianto.
Nel caso, invece, in cui si scelga di inserire impianti negli alveoli mesiali e distali per una protesizzazione di corone a forma di premolare, spesso la estrema contiguità tra loro delle radici può costituire una controindicazione locale all’inserimento in tali alveoli di impianti post-estrattivi per l’impossibilità di garantire un sufficiente spazio per la detersione delle superfici approssimali delle corone protesiche.
Il caso clinico proposto illustra una riabilitazione impianto-protesica effettuata mediante 2 impianti post-estrattivi ritardati posizionati a livello degli alveoli delle radici mesiale e distale di un molare estratto sei settimane prima.
CASO CLINICO
Un paziente di 51 anni, di sesso maschile,non fumatore, presentava i molari 36 e 37 irrimediabilmente compromessi per pregressi processi cariosi.(Fig.1)

Il notevole deficit funzionale era aggravato dalla perdita della corona clinica del 35 per cui il desiderio del paziente era di ripristinare al più presto possibile una funzione masticatoria soddisfacente mediante una riabilitazione con protesi fissa. La mancanza all’arcata antagonista del 27 e la presenza di un setto interradicolare di notevole entità per la accentuata divaricazione delle radici del 36 ci ha permesso di progettare il recupero endodontico e protesico del 35 e l’inserimento di due impianti post-estrattivi ritardati negli alveoli del 36 per la realizzazione di due corone protesiche a forma di premolare.
Dopo l’estrazione delicata del 36 e del 37 e la revisione degli alveoli post estrattivi, si è atteso 6 settimane per ottenere una guarigione ottimale dei tessuti molli (Fig.2),

e si procede all’intervento per l’inserimento di due impianti Straumann negli alveoli delle radici mesiale e distale del 36.
L’ incisione viene effettuata in cresta, al centro della mucosa cheratinizzata con un bisturi Bard Parker n° 12b e si esegue lo scollamento del lembo a spessore totale (Fig. 3).
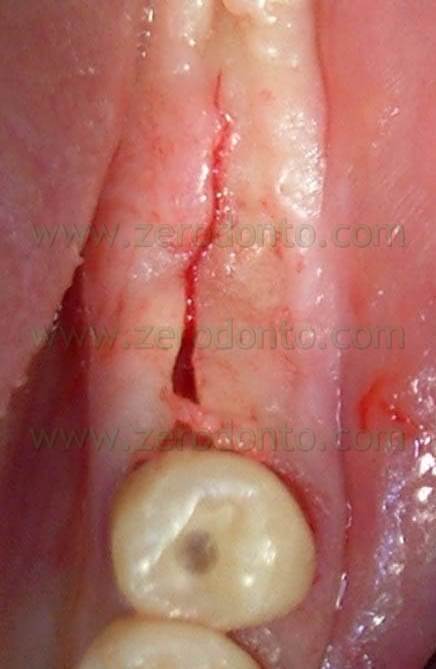
Dopo aver eseguito vestibolarmente e lingualmente delle suture divaricanti si asporta il tessuto di granulazione da entrambi gli alveoli con piccoli cucchiai alveolari di Lucas molto affilati (Fig. 4).
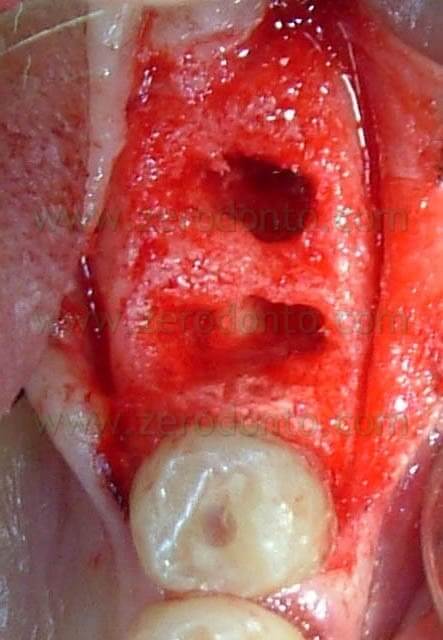
Si procede alla regolarizzazione della cresta ossea mediante l’utilizzo di un dispositivo manuale (Micross® Meta), un grattino che consente di prelevare osso autogeno di tipo corticale. Successivamente si effettua un ulteriore prelievo osseo con il medesimo grattino dalla linea obliqua esterna per avere a disposizione una quantità di osso autologo sufficiente a riempire i gap attorno agli impianti (Fig. 5).
E’ quasi sempre possibile con questi dispositivi monouso molto piccoli prelevare notevoli quantità di osso autologo apicalmente al sito di inserzione gli impianti e nelle zone distali inferiori (Fig.6).

Al fine di ottenere una posizione degli impianti protesicamente guidata ed una corretta distanza interimplantare, si cerca di mesializzare leggermente la preparazione del sito dell’impianto inserito nella radice mesiale e distalizzare quello della radice distale; questo ovviamente è reso possibile dalla mancanza del settimo.
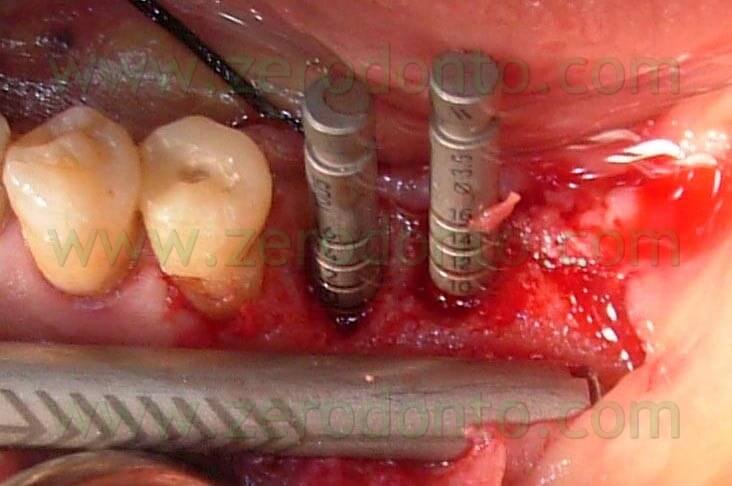
Nell’alveolo mesiale viene quindi posizionato un impianto Straumann a vite piena di diametro 4,1mm e lunghezza 8 mm con componente transmucosa standard per le dimensioni abbastanza ridotte dell’alveolo post-estrattivo rispetto al corpo dell’impianto.
Nell’alveolo distale viene posizionato un impianto ITI TE Ø 4,1-4,8 di lunghezza 8 mm. L’impianto TE consente
di ottenere una maggiore stabilità primaria e permette, per la sua forma tronco-conica, di ridurre l’ampiezza dei gap tra l’osso e la superficie implantare (Fig. 7).
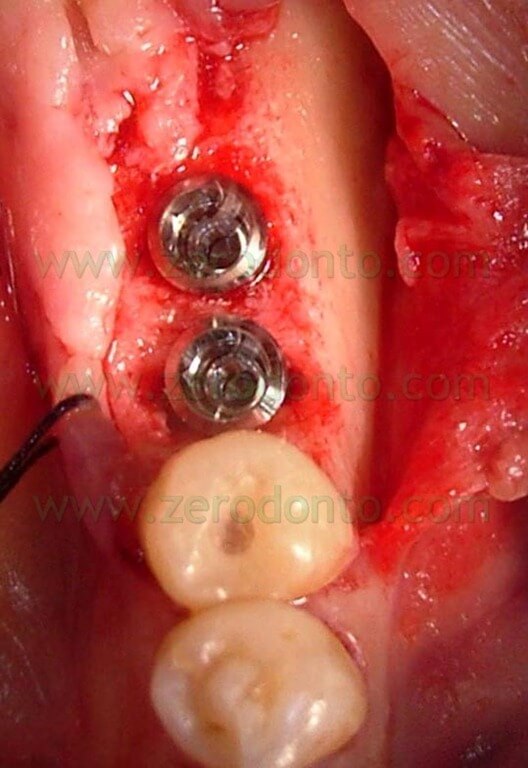
I gap attorno agli impianti post estrattivi inseriti, pur se di ridotte dimensioni, vengono riempiti con l’osso autogeno prelevato mediante il Micross® Meta (Fig. 8); successivamente si procede alla sutura del lembo (Fig. 9).

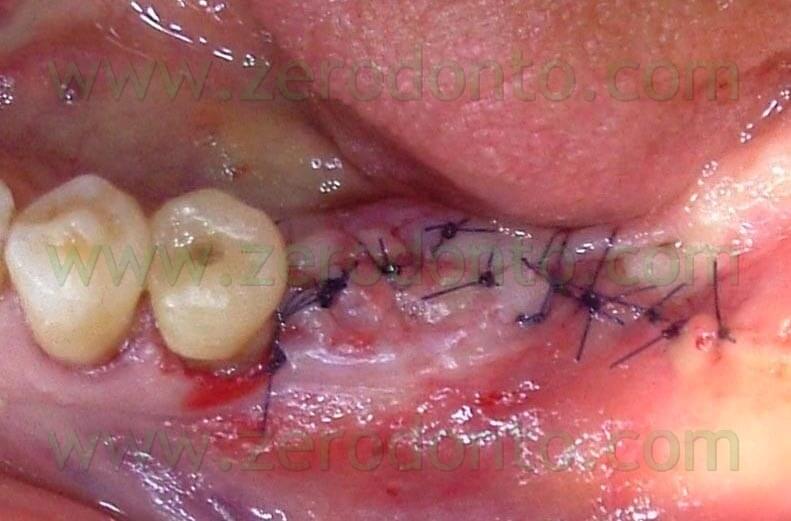
Al paziente viene prescritta terapia antibiotica (amoxicillina 1g. 2 volte al dì per 5gg), antinfiammatori (nimesulide 100mg 2 volte al dì per 3gg) e sciacqui di clorexidina 0,2% per 4 settimane.
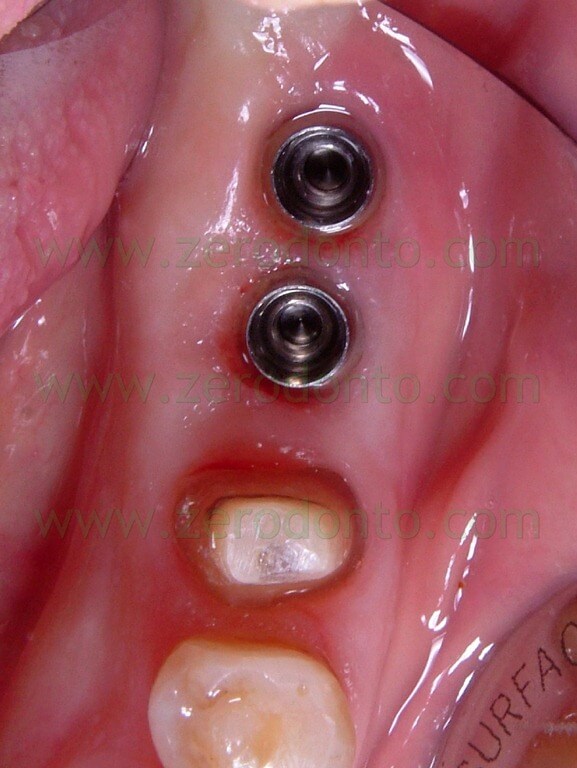
Dopo 3 mesi dall’intervento si procede alla presa dell’impronta per la protesizzazione sia degli impianti che del 35 (Fig. 10).
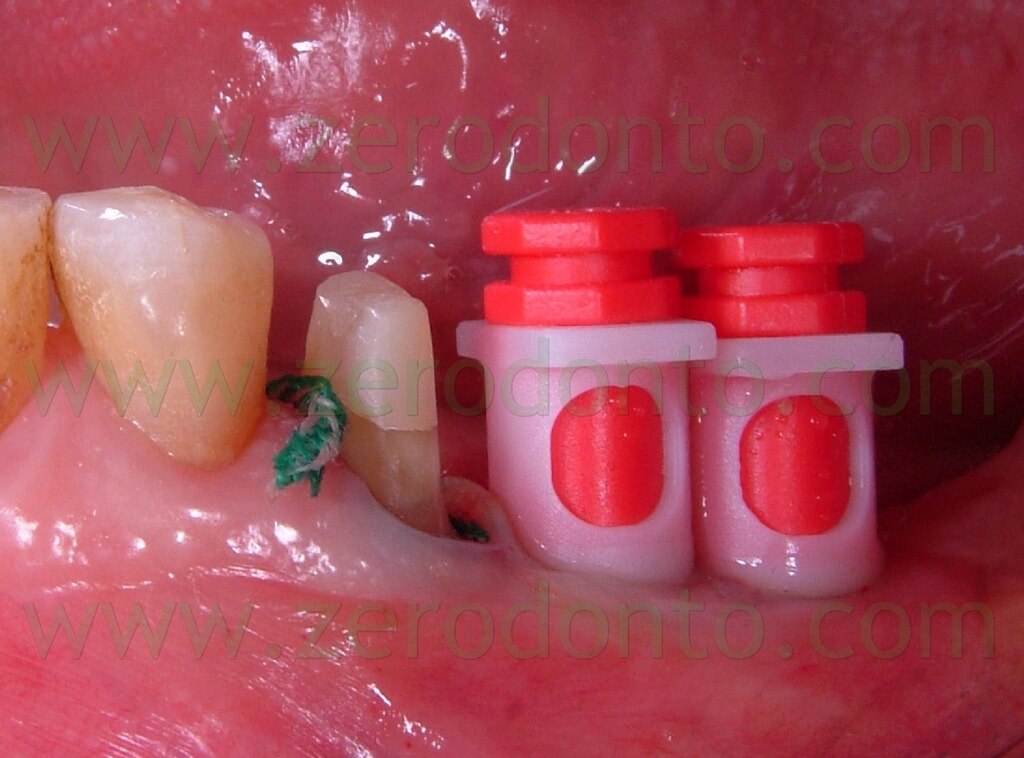
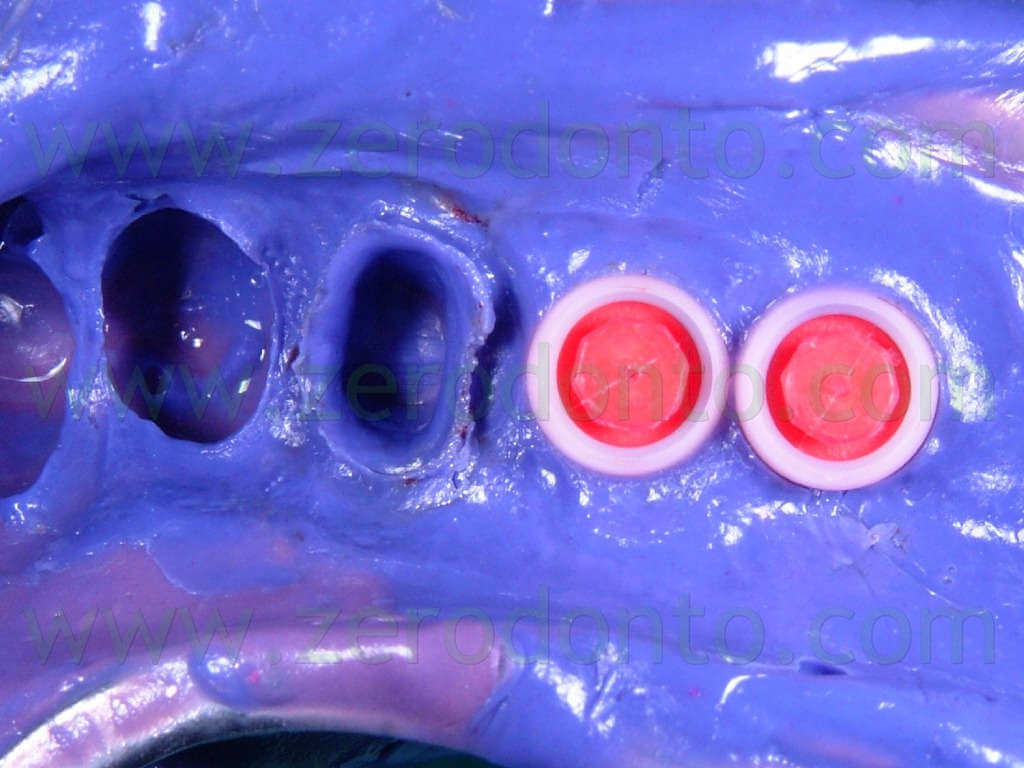
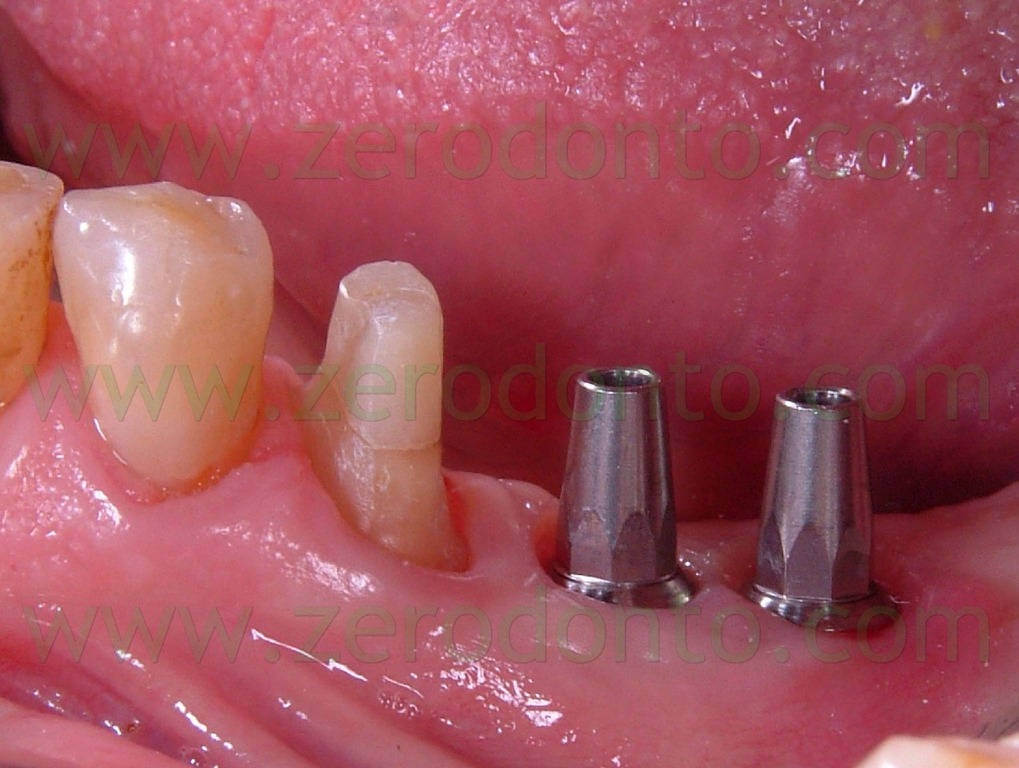
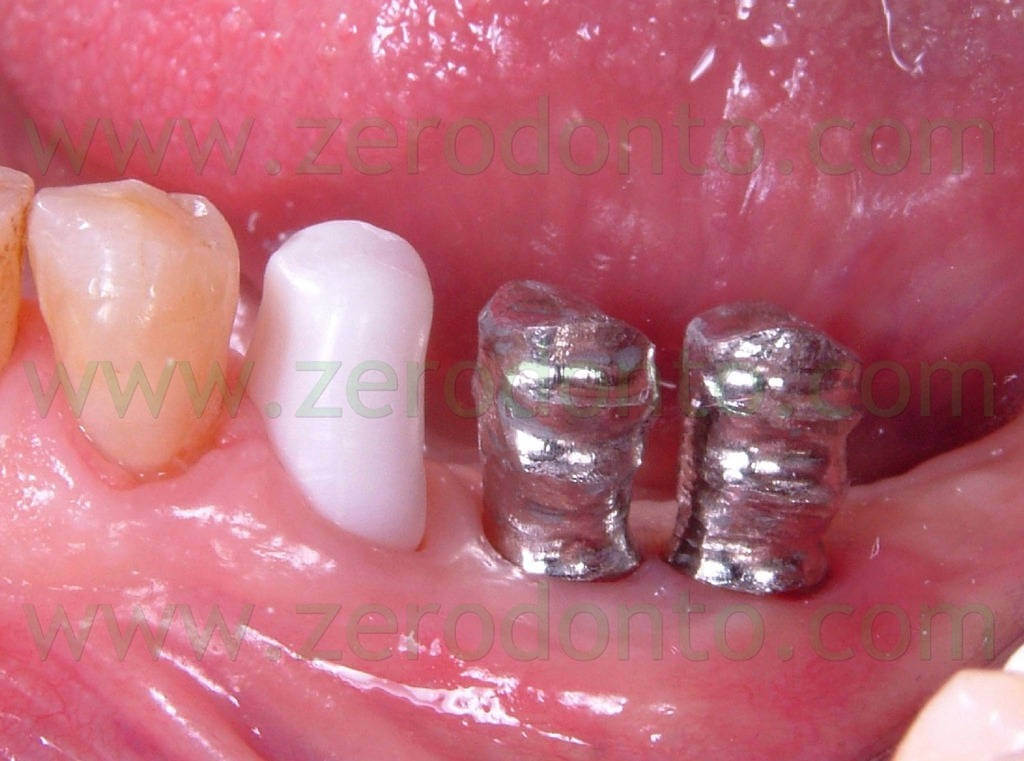
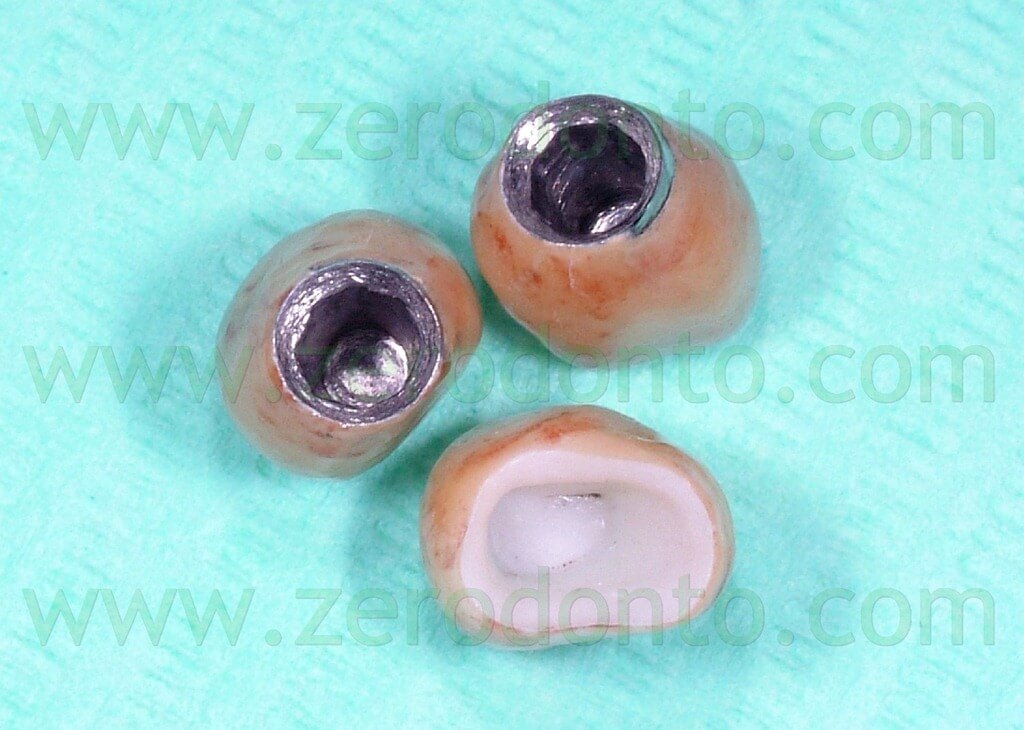
Sugli impianti vengono montati gli opportuni transfer (Fig.11) e viene presa un impronta con l’ausilio di polieteri (Fig 12). I monconi protesici scelti per gli impianti sono del tipo synOcta da 5,5mm (Fig. 13) per supportare delle corone in oro ceramica, mentre il 35, precedentemente preparato, viene protesizzato mediante una corona in ceramica integrale tipo Procera forte che, grazie alle sue qualità di trasparenza e translucenza, ci assicura un ottimo risultato estetico e funzionale (Fig. 14-15-16).

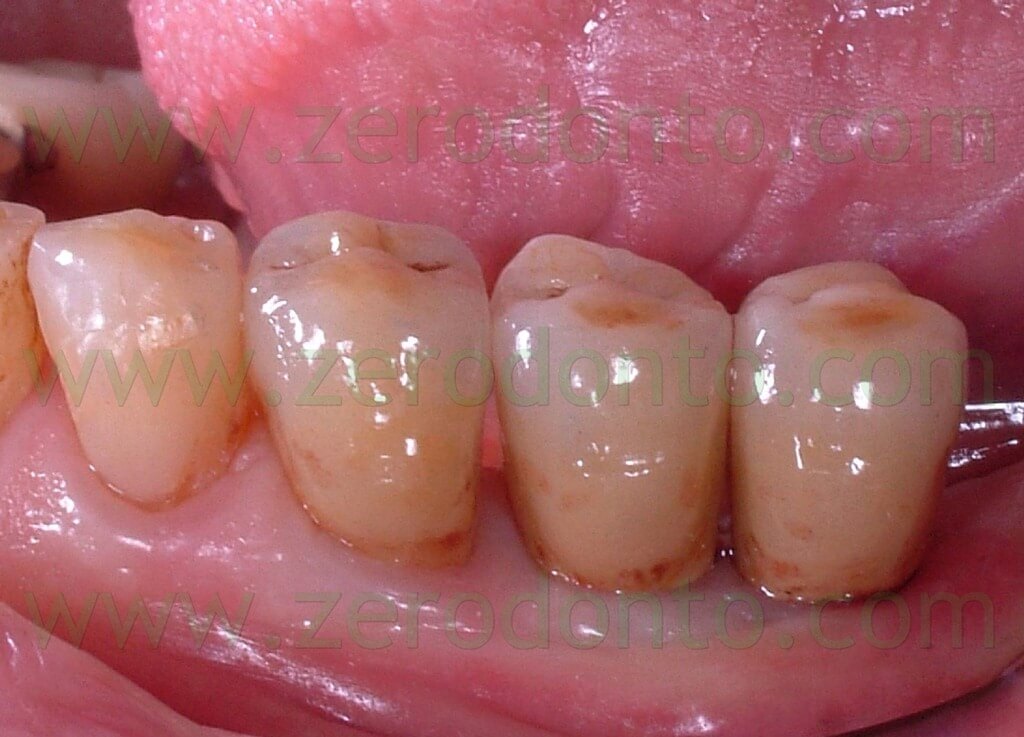
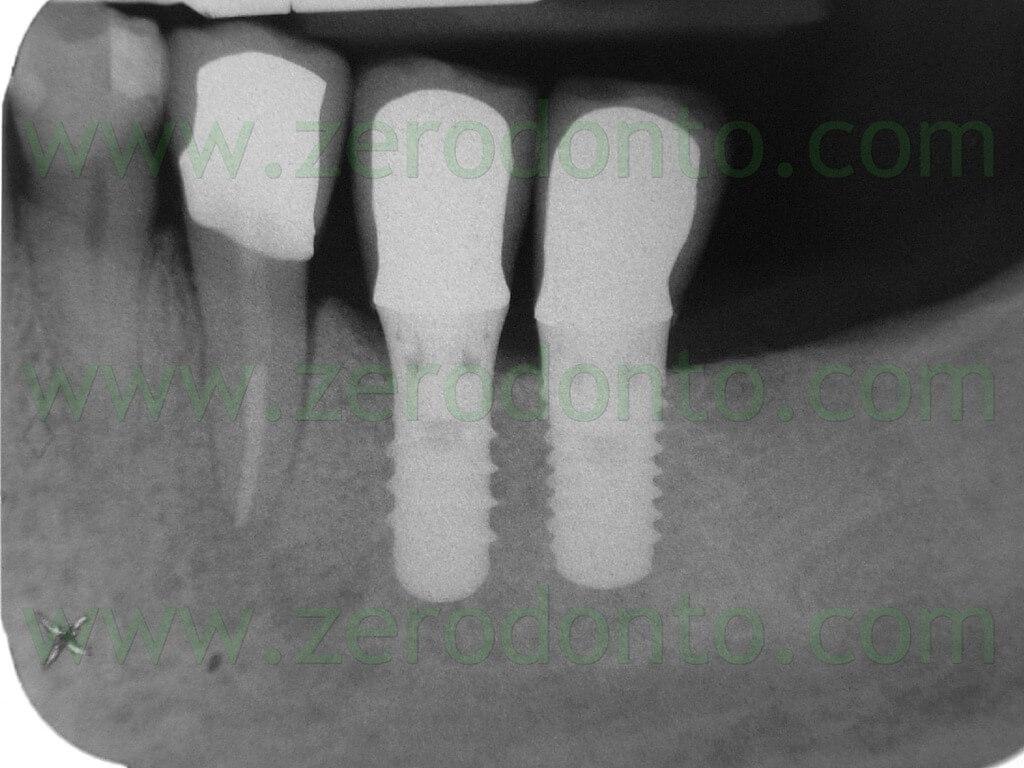
Il controllo clinico e radiografico a sei mesi dalla protesizzazione evidenzia un ottima risposta dei tessuti molli e dell’osso alle sollecitazioni funzionali sia alla visione clinica che radiografica (Fig.17-18-19).

BIBLIOGRAFIA
1) Romeo E, Lops D, Margutti E, Ghisolfi M, Chiapasco M, Vogel G.Long-term survival and success of oral implants in the treatment of full and partial arches: a 7-year prospective study with the ITI dental implant system. Int J Oral Maxillofac Implants. 2004 Mar-Apr;19(2):247-59
2) Isidor F. Loss of osseointegration caused by occlusal load of oral implants. A clinical and radiographic study in monkeys. Clin Oral Implants Res. 1996 Jun;7(2):143-52.
3) Chen ST, Wilson TG Jr, Hammerle CH.Immediate or early placement of implants following tooth extraction: review of biologic basis, clinical procedures, and outcomes. Int J Oral Maxillofac Implants. 2004;19 Suppl:12-25. Review.
4) Cardaropoli G, Araujo M, Hayacibara R, Sukekava F, Lindhe J.Healing of extraction sockets and surgically produced – augmented and non-augmented – defects in the alveolar ridge. An experimental study in the dog. J Clin Periodontol. 2005 May;32(5):435-40.
5) Cardaropoli G, Araujo M, Lindhe J.Dynamics of bone tissue formation in tooth extraction sites. An experimental study in dogs.J Clin Periodontol. 2003 Sep;30(9):809-18.
6) Carlsson GE, Persson G.Morphologic changes of the mandible after extraction and wearing of dentures. A longitudinal, clinical, and x-ray cephalometric study covering 5 years. Odontol Revy. 1967;18(1):27-54.
7) Ghier ME, Quintero G, Assad D, Monaco E, Richardson AC.Bone grafting and guided bone regeneration for immediate dental implants in humans.J Periodontol. 1994 Sep;65(9):881-91.
8) Chen ST, Wilson TG Jr, Hammerle CH.Immediate or early placement of implants following tooth extraction: review of biologic basis, clinical procedures, and outcomes.Int J Oral Maxillofac Implants. 2004;19 Suppl:12-25. Review
9) Hammerle CH, Chen ST, Wilson TG Jr. Consensus statements and recommended clinical procedures regarding the placement of implants in extraction sockets.Int J Oral Maxillofac Implants. 2004;19 Suppl:26-8. Review
DIDASCALIE:
Fig.1 La rx endorale mostra le lesioni a carico di 35, 36 e 37.
Fig.2 Rx dopo avulsione di 36 e 37. Si è proceduto al trattamento endodontico del 35.
Fig.3 L’incisione a tutto spessore al centro della mucosa cheratinizzata.
Fig.4 Visione occlusale degli alveoli dopo l’asportazione del tessuto di granulazione.
Fig.5 Prelievo di osso autologo dalla linea obliqua esterna mediante l’utilizzo di un dispositivo manuale di prelievo osseo corticale (Micross® Meta).
Fig.6 Osso autologo prelevato.
Fig.7 Visione occlusale degli impianti inseriti. Si può notare la presenza di un “gap” di circa 2 mm intorno agli impianti.
Fig.8 L’osso autologo viene inserito attorno agli impianti per riempire i gap.
Fig.9 Sutura.
Fig.10 Visione occlusale all’atto della presa dell’impronta.
Fig.11 Presa dell’impronta mediante l’utilizzo di transfer da impronta e cilindri synOcta di posizionamento rossi.
Fig.12 Particolare dell’impronta in polietere.
Fig.13 I monconi synOcta da 5,5 mm montati sugli impianti.
Fig.14 Prova delle strutture. Sul 35 è stata realizzata una struttura in zirconio che ci permette di ottenere un risultato altamente estetico, mentre sugli impianti è stata utilizzata una lega aurea.
Fig.15 È evidente la traslucenza dello zirconio rispetto ai materiali tradizionali con l’ausilio di una fonte luminosa di notevole intensità.
Fig.16 Aspetto interno delle corone oro-ceramica e della corona zirconio-ceramica.
Fig.17 Visione occlusale degli elementi definitivi a 6 mesi dalla protesizzazione.
Fig.18 Visione vestibolare delle corone dopo 6 mesi.
Fig.19 Rx di controllo a 6 mesi.
Per informazioni:
zerodonto@gmail.com

